-án alakult ki a hőmennyiség fogalma korai szakaszaiban a modern fizika fejlődése, amikor még nem voltak egyértelmű elképzelések arról belső szerkezet anyagok, mi az energia, milyen energiaformák léteznek a természetben és az energia, mint az anyag mozgásának és átalakulásának formája.
A hőmennyiség azt jelenti fizikai mennyiség egyenértékű a hőcsere során az anyagi testnek átadott energiával.
Az elavult hő mértékegysége a kalória, amely 4,2 J, ma gyakorlatilag nem használják, és a joule vette át a helyét.
Kezdetben azt feltételezték, hogy a hőenergia hordozója valami teljesen súlytalan, folyadék tulajdonságaival rendelkező közeg. A hőátadás számos fizikai problémáját megoldották és jelenleg is megoldják ez alapján. A hipotetikus kalória megléte sok alapvetően helyes konstrukció alapja volt. Úgy gondolták, hogy a kalória felszabadul és felszívódik a melegítés és hűtés, az olvadás és a kristályosodás jelenségeiben. A hőátadási folyamatok helyes egyenleteit helytelen fizikai fogalmak alapján kaptuk meg. Ismert egy törvény, amely szerint a hőmennyiség egyenesen arányos a hőcserében részt vevő test tömegével és a hőmérsékleti gradienssel:
Ahol Q a hőmennyiség, m a testtömeg és az együttható Val vel– fajlagos hőkapacitásnak nevezett mennyiség. A fajlagos hőkapacitás a folyamatban részt vevő anyag jellemzője.
A termikus folyamatok eredményeként tiszta gépészeti munka. Például, amikor egy gáz felmelegszik, növeli a térfogatát. Vegyünk egy olyan helyzetet, mint az alábbi képen:

BAN BEN ebben az esetben a mechanikai munka megegyezik a dugattyúra ható gáznyomás erejével, szorozva a dugattyú által nyomás alatt megtett úttal. Természetesen ez a legegyszerűbb eset. De még ebben is észrevehető egy nehézség: a nyomáserő a gáz térfogatától függ, ami azt jelenti, hogy nem állandókkal, hanem változó mennyiségekkel van dolgunk. Mivel mindhárom változó: nyomás, hőmérséklet és térfogat összefügg egymással, a munkaszámítás lényegesen bonyolultabbá válik. Létezik néhány ideális, végtelenül lassú folyamat: izobár, izoterm, adiabatikus és izokhorikus – amelyekre az ilyen számítások viszonylag egyszerűen elvégezhetők. A nyomás függvényében a térfogat grafikonját ábrázoljuk, és a munkát az űrlap integráljaként számítjuk ki.
>>Fizika: Hőmennyiség
A palackban lévő gáz belső energiáját nemcsak munkavégzéssel, hanem a gáz felmelegítésével is megváltoztathatja.
Ha rögzíti a dugattyút ( 13.5. ábra), akkor a gáz térfogata nem változik melegítéskor és nem történik munka. De a gáz hőmérséklete, és ezért annak belső energia növekednek.
Az energia egyik testből a másikba munkavégzés nélkül történő átvitelének folyamatát nevezzük hőcsere vagy hőátadás.
A belső energia hőátadás során bekövetkező változásának mennyiségi mértékét ún hőmennyiség. A hőmennyiséget annak az energiának is nevezik, amelyet a test a hőcsere során lead.
A hőátadás molekuláris képe
A hőcsere során az energia nem alakul át egyik formából a másikba, a forró test belső energiájának egy része átkerül a hideg testbe.
Hőmennyiség és hőkapacitás. Azt már tudod, hogy fel kell melegíteni egy tömeges testet m hőmérsékleten t 1 hőmérsékletig t 2át kell adni a hőmennyiséget:
Amikor egy test lehűl, a végső hőmérséklete t 2 alacsonyabbnak bizonyul, mint a kezdeti hőmérséklet t 1és a test által leadott hőmennyiség negatív.
Együttható c képletben (13.5) nevezzük fajlagos hőkapacitás anyagokat. A fajlagos hőkapacitás számszerűen megegyezik azzal a hőmennyiséggel, amelyet egy 1 kg tömegű anyag kap vagy bocsát ki, ha hőmérséklete 1 K-vel változik.
A fajlagos hőkapacitás nemcsak az anyag tulajdonságaitól függ, hanem a hőátadás folyamatától is. Ha egy gázt állandó nyomáson melegít, az kitágul és működik. Ahhoz, hogy egy gázt állandó nyomáson 1°C-kal felmelegítsen, több hőt kell átadnia, mint állandó térfogaton, amikor a gáz csak felmelegszik.
Folyékony és szilárd anyagok melegítéskor kissé kitágul. Fajlagos hőkapacitásuk állandó térfogaton és állandó nyomáson alig különbözik.
Fajlagos párolgási hő. Ahhoz, hogy egy folyadékot gőzzé alakítsunk a forrás közben, bizonyos mennyiségű hőt kell átadni rá. A folyadék hőmérséklete nem változik, amikor forr. A folyadék gőzzé alakulása állandó hőmérsékleten nem vezet a molekulák kinetikus energiájának növekedéséhez, hanem kölcsönhatásuk potenciális energiájának növekedésével jár. Végül is a gázmolekulák közötti átlagos távolság sokkal nagyobb, mint a folyadékmolekulák között.
Az 1 kg tömegű folyadék állandó hőmérsékletű gőzzé alakításához szükséges hőmennyiséggel számszerűen megegyező mennyiséget ún. fajlagos hő párologtatás. Ezt az értéket betű jelöli rés joule per kilogrammban (J/kg) vannak kifejezve.
A víz fajpárolgási hője nagyon magas: r H2O=2,256 10 6 J/kg 100°C hőmérsékleten. Más folyadékok, például alkohol, éter, higany, kerozin esetében a párolgási hő 3-10-szer kisebb, mint a vízé.
A folyadék tömeggé alakítása m a gőznek annyi hőre van szüksége, mint:
A gőz lecsapódásakor ugyanannyi hő szabadul fel:
A test kristályosodása során felszabaduló hőmennyiség egyenlő:
A test belső energiája változik felmelegedés és hűtés, párolgás és kondenzáció, olvadás és kristályosodás során. Minden esetben bizonyos mennyiségű hő kerül a szervezetbe, illetve távozik onnan.
???
1. Mit nevezünk mennyiségnek melegség?
2. Mitől függ? fajlagos hő anyagok?
3. Mit nevezünk párolgási fajhőnek?
4. Hogyan nevezzük a fajlagos olvadási hőt?
5. Milyen esetekben a hőmennyiség pozitív, és milyen esetekben negatív?
G.Ja.Mjakisev, B.B.Buhovcev, N.N. Szockij, fizika 10. osztály
Az óra tartalma leckejegyzetek keretóra prezentációgyorsítási módszerek támogatása interaktív technológiák Gyakorlat feladatok és gyakorlatok önellenőrző műhelyek, tréningek, esetek, küldetések házi feladat megbeszélés kérdések szónoki kérdések a tanulóktól Illusztrációk audio, videoklippek és multimédia fényképek, képek, grafikák, táblázatok, diagramok, humor, anekdoták, viccek, képregények, példázatok, mondások, keresztrejtvények, idézetek Kiegészítők absztraktokat cikkek trükkök a kíváncsiskodóknak bölcsők tankönyvek alap- és kiegészítő szótár egyéb Tankönyvek és leckék javításaa tankönyv hibáinak javítása egy töredék frissítése a tankönyvben, innováció elemei a leckében, az elavult ismeretek újakkal való helyettesítése Csak tanároknak tökéletes leckék naptári tervet az évre iránymutatásokat vitaprogramok Integrált leckékHa javításai vagy javaslatai vannak ehhez a leckéhez,
730. Miért használnak vizet egyes mechanizmusok hűtésére?
A víznek nagy fajlagos hőkapacitása van, ami elősegíti a jó hőelvonást a mechanizmusból.
731. Melyik esetben kell több energiát költeni: egy liter vizet 1 °C-kal vagy száz gramm vizet 1 °C-kal felmelegíteni?
Egy liter vizet melegíteni, hiszen mint több tömeg, annál több energiát kell elkölteni.
732. Cupronickel ezüst és egyenlő tömegű ezüstvillák kerültek forró vízbe. Ugyanannyi hőt kapnak a vízből?
A réz-nikkel villa több hőt kap, mivel a réz-nikkel fajhője nagyobb, mint az ezüsté.
733. Egy azonos tömegű ólomdarabot és egy öntöttvas darabot háromszor ütöttek kalapáccsal. Melyik darab lett melegebb?
Az ólom jobban felmelegszik, mert fajlagos hőkapacitása kisebb, mint az öntöttvasé, és kevesebb energiát igényel az ólom felmelegítése.
734. Az egyik lombikban víz, a másikban azonos tömegű és hőmérsékletű kerozin. Mindegyik lombikba egy ugyanolyan melegített vaskockát csepegtettünk. Mi fog még jobban felmelegedni magas hőmérsékletű– víz vagy kerozin?
Kerozin.
735. Miért kevésbé élesek a téli és nyári hőmérséklet-ingadozások a tengerparti városokban, mint a szárazföldi városokban?
A víz lassabban melegszik fel és hűl le, mint a levegő. Télen lehűl, és meleg légtömegeket szállít a szárazföldre, ami melegebbé teszi a tengerpart klímáját.
736. Az alumínium fajlagos hőkapacitása 920 J/kg °C. Mit is jelent ez?
Ez azt jelenti, hogy 1 kg alumínium 1 °C-kal való felmelegítéséhez 920 J energiát kell elkölteni.
737. Az 1 kg tömegű alumínium- és rézrudakat 1 °C-kal lehűtik. Mennyire változik az egyes blokkok belső energiája? Melyik sávnál fog ez jobban megváltozni és mennyivel?
738. Mennyi hő szükséges egy kilogramm vastömb 45 °C-os felmelegítéséhez?

739. Mekkora hőmennyiség szükséges 0,25 kg víz 30 °C-ról 50 °C-ra való felmelegítéséhez?

740. Hogyan változik két liter víz belső energiája 5 °C-os felmelegítés esetén?

741. Mekkora hőmennyiség szükséges 5 g víz 20 °C-ról 30 °C-ra való felmelegítéséhez?

742. Mekkora hő szükséges egy 0,03 kg tömegű alumíniumgolyó 72 °C-os felmelegítéséhez?

743. Számítsa ki 15 kg réz 80 °C-os felmelegítéséhez szükséges hőmennyiséget!
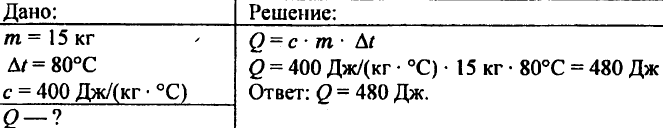
744. Számítsa ki 5 kg réz 10 °C-ról 200 °C-ra való felmelegítéséhez szükséges hőmennyiséget!
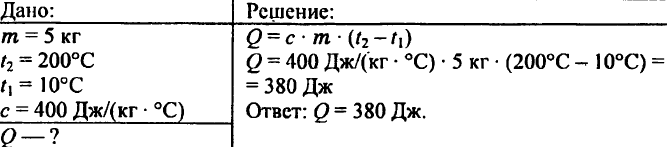
745. Mekkora hőmennyiség szükséges 0,2 kg víz 15 °C-ról 20 °C-ra való felmelegítéséhez?

746. A 0,3 kg tömegű víz 20 °C-ra lehűlt. Mennyivel csökkent a víz belső energiája?

747. Mekkora hőmennyiség szükséges 0,4 kg 20 °C hőmérsékletű víz 30 °C hőmérsékletre történő felmelegítéséhez?

748. Mekkora hőmennyiség költ el 2,5 kg víz 20 °C-os felmelegítéséhez?

749. Mennyi hő szabadul fel, amikor 250 g víz 90 °C-ról 40 °C-ra hűlt le?
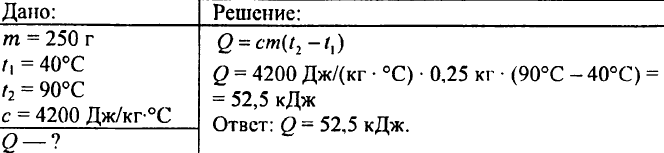
750. Mekkora hőmennyiség szükséges 0,015 liter víz 1 °C-os felmelegítéséhez?
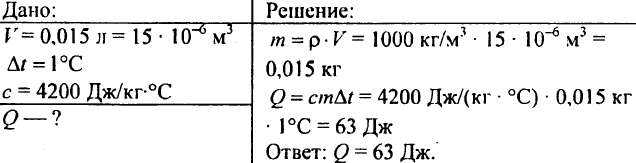
751. Számítsa ki egy 300 m3 térfogatú tó 10 °C-os fűtéséhez szükséges hőmennyiséget?

752. Mennyi hőt kell hozzáadni 1 kg vízhez, hogy a hőmérséklete 30 °C-ról 40 °C-ra emelkedjen?

753. A 10 liter térfogatú víz 100 °C-ról 40 °C-ra hűlt. Mennyi hő szabadult fel ezalatt?

754. Számítsa ki 1 m3 homok 60 °C-os felmelegítéséhez szükséges hőmennyiséget!

755. Levegőtérfogat 60 m3, fajhőteljesítmény 1000 J/kg °C, levegő sűrűsége 1,29 kg/m3. Mennyi hő szükséges a 22°C-ra emeléséhez?
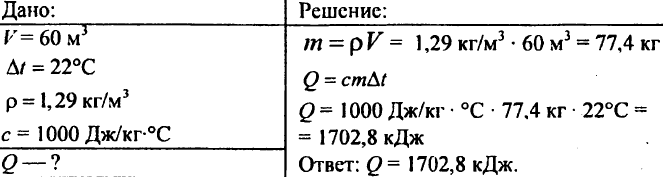
756. A vizet 10 °C-ra melegítettük, és 4,20 103 J hőt használtunk fel. Határozza meg a víz mennyiségét.

757. 20,95 kJ hőt adtak át 0,5 kg tömegű víznek. Mi lett a víz hőmérséklete, ha a kezdeti vízhőmérséklet 20 °C volt?
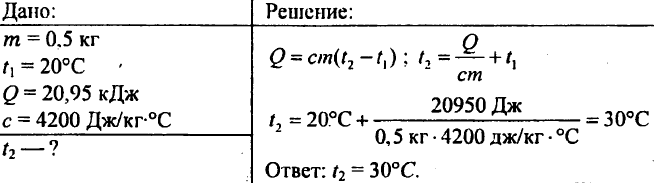
758. Egy 2,5 kg tömegű rézserpenyőbe 8 kg 10 °C-os vizet töltünk. Mekkora hő szükséges ahhoz, hogy a serpenyőben felforrósodjon a víz?

759. Egy 300 g tömegű réz üstbe egy liter 15 °C-os vizet öntünk Mekkora hő szükséges az üstben lévő víz 85 °C-ra történő felmelegítéséhez?
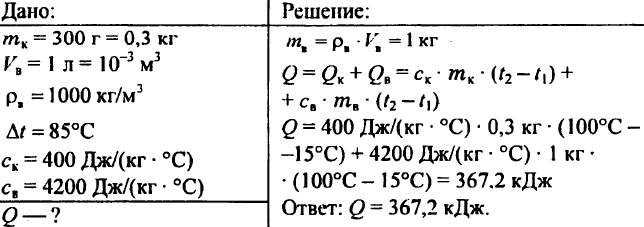
760. Egy 3 kg tömegű hevített gránitdarabot vízbe teszünk. A gránit 12,6 kJ hőt ad át a víznek, 10 °C-kal lehűtve. Mekkora a kő fajlagos hőkapacitása?
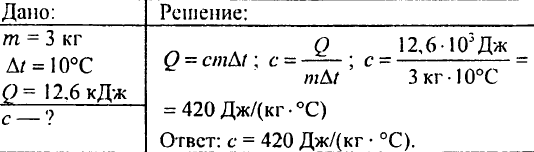
761. 50 °C-os forró vizet adtunk 5 kg 12 °C-os vízhez, így 30 °C-os keveréket kaptunk. mennyi vizet adtál hozzá?

762. 20 °C-os vizet adtunk 3 liter 60 °C-os vízhez, így 40 °C-os vizet kaptunk. mennyi vizet adtál hozzá?

763. Milyen hőmérsékletű lesz a keverék, ha 600 g 80 °C-os vizet összekeverünk 200 g 20 °C-os vízzel?

764. Egy liter 90 °C-os vizet öntöttünk 10 °C-os vízbe, és a víz hőmérséklete 60 °C lett. Hányan voltak hideg víz?

765. Határozza meg, mennyit kell önteni az edénybe! forró víz 60 °C-ra melegítve, ha az edényben már van 20 liter 15 °C-os hideg víz; a keverék hőmérséklete 40 °C legyen.
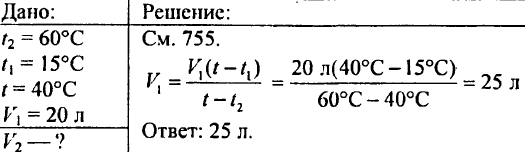
766. Határozza meg, mennyi hő szükséges 425 g víz 20 °C-os felmelegítéséhez!

767. Hány fokkal melegszik fel 5 kg víz, ha a víz 167,2 kJ-t kap?

768. Mennyi hő szükséges m gramm t1 hőmérsékletű víz t2 hőmérsékletre való felmelegítéséhez?
769. 2 kg vizet öntünk egy kaloriméterbe 15 °C hőmérsékleten. Milyen hőmérsékletre melegszik fel a kaloriméteres víz, ha 500 g-os, 100 °C-ra melegített sárgaréz súlyt engedünk bele? A sárgaréz fajlagos hőkapacitása 0,37 kJ/(kg °C).
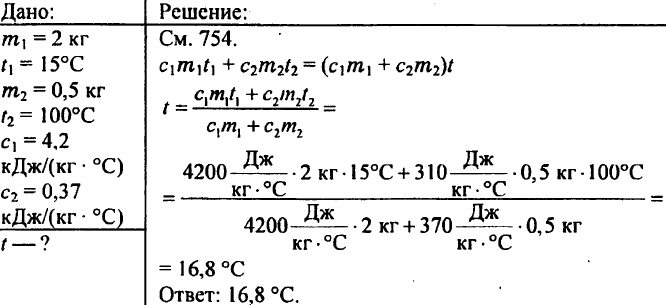
770. Egyforma térfogatú réz-, ón- és alumíniumdarabok vannak. Ezen darabok közül melyik a legnagyobb és melyik a legkisebb hőkapacitású?

771. A kaloriméterbe 450 g vizet öntöttünk, melynek hőmérséklete 20 °C volt. Amikor 200 g 100 °C-ra melegített vasreszeléket mártottunk ebbe a vízbe, a víz hőmérséklete 24 °C lett. Határozza meg a fűrészpor fajlagos hőkapacitását!

772. Egy 100 g tömegű rézkaloriméter 738 g vizet tartalmaz, melynek hőmérséklete 15 °C. Ebbe a kaloriméterbe 200 g rezet engedtünk 100 °C hőmérsékleten, majd a kaloriméter hőmérséklete 17 °C-ra emelkedett. Mekkora a réz fajlagos hőkapacitása?

773. Egy 10 g tömegű acélgolyót kiveszünk a sütőből, és 10 °C-os vízbe helyezzük. A víz hőmérséklete 25 °C-ra emelkedett. Milyen hőmérsékletű volt a golyó a sütőben, ha a víz tömege 50 g? Az acél fajlagos hőkapacitása 0,5 kJ/(kg °C).

777. 50 g 19 °C-os vizet öntöttünk 150 g tömegű, 35 °C-os vízbe. Milyen hőmérsékletű a keverék?

778. 5 kg tömegű 90 °C-os vizet öntöttünk egy 2 kg tömegű öntöttvas fazékba 10 °C hőmérsékleten. Milyen hőmérsékletű volt a víz?

779. Egy 2 kg tömegű acélvágót 800 °C-ra melegítettünk, majd 15 liter vizet tartalmazó edénybe eresztettünk 10 °C hőmérsékleten. Milyen hőmérsékletre melegszik fel a víz az edényben?

(Jelzés: A probléma megoldásához létre kell hozni egy egyenletet, amelyben az edényben lévő víz ismeretlen hőmérsékletét a vágó leengedése után ismeretlennek vesszük.)
780. Milyen hőmérsékletű lesz a víz, ha 0,02 kg 15 °C-os, 0,03 kg 25 °C-os és 0,01 kg 60 °C-os vizet keverünk össze?
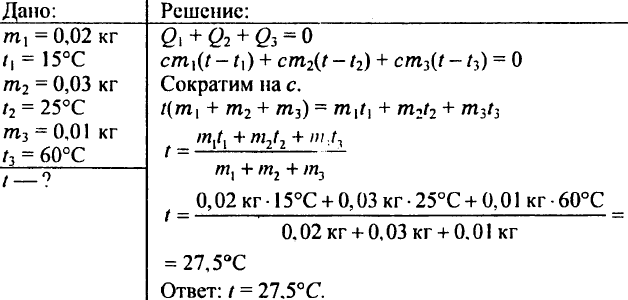
781. Jól szellőző osztály fűtéséhez a szükséges hőmennyiség 4,19 MJ óránként. A víz 80 °C-on lép be a fűtőtestekbe, és 72 °C-on hagyja el azokat. Mennyi vizet kell adagolni óránként a radiátorokhoz?

782. 0,1 kg tömegű ólmot 100 °C hőmérsékleten 0,04 kg tömegű alumínium kaloriméterbe merítettünk, amely 0,24 kg vizet tartalmazott 15 °C hőmérsékleten. Ezután a kaloriméter hőmérséklete elérte a 16 °C-ot. Mekkora az ólom fajhője?

Tanulási cél: Ismertesse meg a hőmennyiség és a fajlagos hőkapacitás fogalmát.
Fejlesztési cél: A figyelmesség nevelése; tanítani gondolkodni, következtetéseket levonni.
1. A téma aktualizálása
2. Új anyag magyarázata. 50 perc.
Azt már tudod, hogy a test belső energiája munkavégzés közben és hőátadással (munkavégzés nélkül) is változhat.
Azt az energiát, amelyet a test a hőátadás során nyer vagy veszít, hőmennyiségnek nevezzük. (írd a füzetbe)
Ez azt jelenti, hogy a hőmennyiség mértékegységei is Joule ( J).
Kísérletet végzünk: két pohárban 300 g, a másikban 150 g víz van, és egy 150 g tömegű vashengert mindkét poharat ugyanarra a csempére helyezzük. Egy idő után a hőmérők azt mutatják, hogy a víz az edényben, amelyben a test található, gyorsabban felmelegszik.
Ez azt jelenti, hogy 150 g vas felmelegítése kevesebb hőt igényel, mint 150 g víz felmelegítése.
A testnek átadott hő mennyisége attól függ, hogy milyen anyagból áll a test. (írd a füzetbe)
Felvetjük a kérdést: ugyanannyi hő szükséges a testek azonos hőmérsékletű felmelegítéséhez? egyenlő tömegű, de különböző anyagokból áll?
Kísérletet végzünk Tyndall készülékével a fajlagos hőkapacitás meghatározására.
Következtetésünk: a különböző anyagokból készült, de azonos tömegű testek lehűtve feladják, és ugyanannyi fokkal felmelegítve eltérő mennyiségű hőt igényelnek.
Következtetéseket vonunk le:
1. Különböző anyagokból álló, azonos tömegű testek azonos hőmérsékletre történő felmelegítéséhez különböző hőmennyiség szükséges.
2. Egyenlő tömegű, különböző anyagokból álló és azonos hőmérsékletre hevített testek. Ugyanannyi fokkal hűtve különböző mennyiségű hő szabadul fel.
arra következtetünk különböző anyagok egységnyi tömegének egy fokkal való felmelegítéséhez szükséges hőmennyiség változik.
Megadjuk a fajlagos hőkapacitás definícióját.
Egy anyag fajlagos hőkapacitásának nevezzük azt a fizikai mennyiséget, amely számszerűen megegyezik azzal a hőmennyiséggel, amelyet egy 1 kg tömegű testnek át kell adni ahhoz, hogy a hőmérséklete 1 fokkal megváltozzon.
Adja meg a fajlagos hőkapacitás mértékegységét: 1J/kg*fok.
A kifejezés fizikai jelentése : A fajhőkapacitás azt mutatja meg, hogy 1 g (kg) anyag belső energiája mennyivel változik 1 fokkal felmelegítve vagy lehűtve.
Nézzük meg néhány anyag fajlagos hőkapacitásának táblázatát.
A problémát analitikusan oldjuk meg
Mennyi hő szükséges egy pohár víz (200 g) 20 0-ról 70 0 C-ra való felmelegítéséhez.
1 g/1 g melegítéséhez 4,2 J szükséges.
És 200 g 1 g-mal történő felmelegítéséhez még 200-ra van szükség - 200 * 4,2 J.
És 200 g (70 0 -20 0) hevítéséhez további (70-20) - 200 * (70-20) * 4,2 J
Az adatokat behelyettesítve Q = 200 * 50 * 4,2 J = 42000 J.
Írjuk fel a kapott képletet a megfelelő mennyiségekkel!
4. Mi határozza meg, hogy egy test mennyi hőt kap felmelegítéskor?
Felhívjuk figyelmét, hogy bármely test felmelegítéséhez szükséges hőmennyiség arányos a test tömegével és hőmérsékletének változásával.
Két azonos tömegű henger van: vas és sárgaréz. Ugyanannyi hő szükséges a felfűtéshez, ugyanannyi fokra? Miért?
Mekkora hőmennyiség szükséges 250 g víz 20 o-ról 60 0 C-ra való felmelegítéséhez.
Mi a kapcsolat a kalória és a joule között?
A kalória az a hőmennyiség, amely 1 g víz 1 fokkal történő felmelegítéséhez szükséges.
1 cal = 4,19 = 4,2 J
1 kcal = 1000 cal
1kcal=4190J=4200J
3. Problémamegoldás. 28 perc.
Ha 1 kg tömegű, forrásban lévő vízben melegített ólom-, ón- és acélhengereket jégre teszünk, azok lehűlnek, és az alattuk lévő jég egy része megolvad. Hogyan változik a hengerek belső energiája? Melyik henger alatt fog megolvadni? több jég, amely alatt – kevesebb?
5 kg súlyú fűtött kő. Vízben 1 fokkal hűtve 2,1 kJ energiát ad át neki. Mekkora a kő fajlagos hőkapacitása?
A véső keményítésekor először 650 0-ra hevítették, majd olajba eresztették, ahol 50 0 C-ra hűtött. Mennyi hő szabadul fel, ha tömege 500 gramm.
Mennyi hőt használtak fel a 35 kg-os kompresszor főtengelyéhez készült acél nyersdarab 20 0-ról 1220 0 C-ra melegítésére.
Önálló munkavégzés
Milyen típusú hőátadás?
A tanulók kitöltik a táblázatot.
5. Házi feladat: Peryshkin A.V. „Fizika 8” § 7, 8; feladatgyűjtemény 7-8 Lukashik V.I. No. 778-780, 792,793 2 perc.
Ebben a leckében megtanuljuk, hogyan kell kiszámítani a test felmelegítéséhez szükséges vagy a hűtés során felszabaduló hőmennyiséget. Ehhez összefoglaljuk az előző leckéken elsajátított ismereteket.
Ezenkívül megtanuljuk a hőmennyiség képletével kifejezni a fennmaradó mennyiségeket ebből a képletből, és más mennyiségek ismeretében kiszámítani azokat. A hőmennyiség kiszámítására szolgáló megoldással kapcsolatos probléma példáját is figyelembe kell venni.
Ezt a leckét a test felmelegedésekor vagy lehűtésekor felszabaduló hőmennyiség kiszámítására szolgál.
Számítási képesség szükséges mennyiség a melegség nagyon fontos. Erre például akkor lehet szükség, amikor kiszámolják azt a hőmennyiséget, amelyet a helyiség fűtéséhez a víznek kell átadni.
Rizs. 1. Az a hőmennyiség, amelyet át kell adni a víznek a helyiség fűtéséhez
Vagy a különféle motorokban az üzemanyag elégetésekor felszabaduló hőmennyiség kiszámításához:

Rizs. 2. Az a hőmennyiség, amely felszabadul, amikor az üzemanyag eléget a motorban
Erre az ismeretre van szükség például a Nap által kibocsátott és a Földre eső hőmennyiség meghatározásához is:

Rizs. 3. A Nap által kibocsátott és a Földre eső hőmennyiség
A hőmennyiség kiszámításához három dolgot kell tudnod (4. ábra):

Rizs. 4. Mit kell tudni a megállapításhoz
A hőmennyiség kiszámításának képlete a következőképpen néz ki:
Ebben a képletben a következő mennyiségek jelennek meg:
A joule-ban mért hőmennyiség (J);
Egy anyag fajlagos hőkapacitását mértékegységben mérik;
- hőmérséklet-különbség, Celsius fokban mérve ().
Tekintsük a hőmennyiség kiszámításának problémáját.
Feladat
Egy gramm tömegű rézüveg liter térfogatú vizet tartalmaz hőmérsékleten. Mennyi hőt kell átadni egy pohár víznek, hogy a hőmérséklete egyenlő legyen?

Rizs. 5. A problémakörülmények szemléltetése
Először írunk fel egy rövid feltételt ( Adott), és konvertálja át az összes mennyiséget a nemzetközi rendszerbe (SI).
|
Adott: |
SI |
|
|
Megtalálja: |
Megoldás:
Először is határozzuk meg, milyen más mennyiségekre van szükségünk a probléma megoldásához. A fajlagos hőkapacitás táblázatát (1. táblázat) felhasználva találjuk (a réz fajhőkapacitása, mivel feltétel szerint az üveg réz), (a víz fajhőkapacitása, mivel feltétel szerint víz van az üvegben). Ezenkívül tudjuk, hogy a hőmennyiség kiszámításához víztömegre van szükségünk. A feltétel szerint csak a kötetet adjuk meg. Ezért a táblázatból vesszük a víz sűrűségét: (2. táblázat).
asztal 1. Egyes anyagok fajlagos hőkapacitása,
asztal 2. Egyes folyadékok sűrűsége
Most már minden megvan, ami a probléma megoldásához szükséges.
Vegye figyelembe, hogy a végső hőmennyiség a rézüveg felmelegítéséhez szükséges hőmennyiség és a benne lévő víz felmelegítéséhez szükséges hőmennyiség összegéből áll:
Először számítsuk ki a rézüveg felmelegítéséhez szükséges hőmennyiséget:
A víz felmelegítéséhez szükséges hőmennyiség kiszámítása előtt számítsuk ki a víz tömegét a 7. osztályból ismert képlettel:
Most kiszámolhatjuk:
Akkor kiszámolhatjuk:
Emlékezzünk, mit jelent a kilojoule. A „kilo” előtag azt jelenti ![]() .
.
Válasz:.
Az ehhez a fogalomhoz kapcsolódó hőmennyiség (úgynevezett közvetlen problémák) és mennyiségek meghatározásával kapcsolatos problémák megoldásának kényelme érdekében az alábbi táblázatot használhatja.
|
Szükséges mennyiség |
Kijelölés |
Egységek |
A mennyiség képlete |
|
|
A hőmennyiség |